국내 개발 코로나19 혈장분획치료제 2상 임상 승인
코로나19 치료제·백신 국내 임상시험 총 16건 진행
국내 개발 코로나19 혈장분획치료제 2상 임상 승인
한국자연치유 연합뉴스 | 편집부
코로나19 치료제·백신 국내 임상시험 총 16건 진행
식품의약품안전처(이의경 처장)은 국내 개발 코로나19 혈장분획치료제 ‘GC5131’에 대하여 2상 임상시험을 8월 20일 승인하였다.
이로써 현재 국내에서 코로나19 관련하여 진행 중인 치료제 및 백신의 임상시험은 총 16건(치료제 14건, 백신 2건)이 되었니다.
이번에 승인한 ‘GC5131’은 ‘녹십자’에서 코로나19 완치자의 혈장을 이용해 개발 중인 ‘고면역글로불린(Hyper-immune Globulin)’ 성분 의약품으로, 코로나19 환자를 대상으로 안전성과 유효성을 평가하는 2상 임상시험을 진행하게 된다.
|
임상시험 단계 |
|
|
(임상 1상) 최초로 사람에게 투여하여 안전성, 약동학 등을 평가 (임상 2상) 1상 종료 후, 대상 환자들에게 투여하여 치료효과를 탐색 (임상 3상) 2상 종료 후, 많은 환자들에게 투여하여 안전성 및 치료효과를 확증 ‘1상과 2상’(1/2상) 또는 ‘2상과 3상’(2/3상)을 동시 진행하는 경우도 있음 |
|
해당 제품은 코로나19 완치자의 혈액 중 혈장을 대량으로 수집한 후 여러 공정을 거쳐 제품화한 것으로 코로나19 중화항체가 농축된 면역글로불린이다.
중화항체 : 코로나19 바이러스를 중화(무력화)할 수 있는 항체
면역글로불린 : 혈장 성분 중 면역에 중요한 역할(항원-항체반응)을 하는 단백질
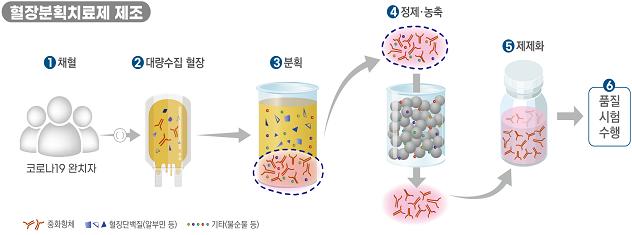
<혈장분획치료제 제조공정 개요>
|
➊ 코로나19 완치자로부터 혈장을 채혈 합니다 ➋ 코로나19 완치자 혈장을 대량으로 모읍니다. ➌ 혈장 내 다른 성분(알부민, 혈액응고인자 등)과 중화항체가 포함된 ➍ 분리된 면역글로불린을 정제‧농축하여 불순물을 제거합니다. ➎ 제제화하여 ‘혈장분획치료제’를 생산합니다. ➏ 품질시험을 실시하고 적합한 제품을 출하합니다. |
식약처는 지난 3월부터 혈장분획치료제 개발을 위해 사전상담을 진행해 왔으며,
원료물질인 혈장이 인체에서 유래하고 중화항체를 이용해 질병을 치료하는 동일 원리를 적용한 제품이 예전부터 개발되어 사용되고 있어 임상 1상 시험을 면제하였습니다.
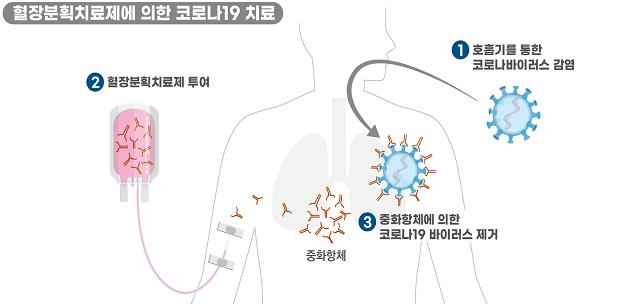
<혈장분획치료제 작용 원리>
|
➊ 코로나19 바이러스가 호흡기를 통해 침입하여 감염을 일으킵니다. ➋ 환자에게 혈장분획치료제를 투여합니다. ➌ 투여된 중화항체가 침입한 코로나19 바이러스를 제거합니다. |
참고로 해외에서도 프랑스, 중국, 일본 및 이탈리아에서 혈장분획치료제를 개발 중이며, 현재 6개의 소규모 임상시험이 진행 중에 있다.
식약처는 코로나19 치료제·백신 개발에 대한 국민적 관심이 큰 만큼 앞으로도 국내 개발 제품의 임상시험 현황에 대해서 신속하게 정보를 전달하도록 하겠다.
또한, 안전하고 효과 있는 코로나19 치료제·백신이 신속히 개발될 수 있도록 최대한 지원할 계획이다.
편집부 FCN FM교육방송 이승훈 기자(fmebsnews@fmebs.com)
<저작권자 © 한국자연치유 연합뉴스, 무단 전재 및 재배포 금지>